Innovación en terapias teranósticas: avances y beneficios clínicos
Las terapias teranósticas representan un avance destacado en la medicina nuclear moderna. Este enfoque combina en un único procedimiento el diagnóstico y el tratamiento de enfermedades, permitiendo una intervención más precisa y personalizada. Su aplicación ha sido especialmente significativa en oncología, donde facilita el manejo de cánceres avanzados o resistentes.
Recientes desarrollos tecnológicos, como el uso de radionúclidos específicos —entre ellos, el lutecio-177 y el actinio-225—, junto con herramientas innovadoras como los gemelos digitales, están optimizando los resultados clínicos y ampliando las posibilidades terapéuticas. Estas innovaciones no solo han mejorado la eficacia de los tratamientos, sino que también han reducido los efectos secundarios y mejorado la calidad de vida de los pacientes.
Este artículo analizará cómo estas terapias están transformando el panorama clínico, explorando sus avances más recientes, sus beneficios en la práctica médica y los retos asociados a su implementación.
¿Qué son las terapias teranósticas y cómo funcionan?
Las terapias teranósticas son un enfoque innovador en la medicina nuclear que integra el diagnóstico y el tratamiento de enfermedades en un único procedimiento. El término proviene de la combinación de las palabras "terapia" y "diagnóstico". Este enfoque permite identificar y tratar con precisión patologías complejas, principalmente en oncología, mediante el uso de radiofármacos especializados.
Los radiofármacos empleados en las terapias teranósticas están diseñados para localizar células malignas y administrar radiación directamente a los tejidos afectados. Esto mejora la eficacia del tratamiento y minimiza el daño a los tejidos sanos circundantes. Este enfoque no solo optimiza los resultados clínicos, sino que también reduce la necesidad de intervenciones adicionales.
Un enfoque dual: diagnóstico y tratamiento combinados
Las terapias teranósticas combinan la capacidad de identificar la localización exacta de una enfermedad mediante técnicas de imagen, como la tomografía por emisión de positrones (PET), con la administración de radiación terapéutica dirigida.
Por ejemplo, el lutecio-177 (Lu-177) se utiliza para tratar tumores neuroendocrinos. En un primer paso, el radiofármaco marcado permite visualizar el tumor a través de una imagen PET, proporcionando información precisa sobre su tamaño y localización. Posteriormente, el mismo compuesto libera radiación beta directamente sobre las células tumorales, destruyéndolas sin afectar el tejido sano.
Este enfoque dual mejora significativamente la personalización de los tratamientos, ya que permite ajustar las dosis y monitorear en tiempo real la eficacia del procedimiento. Como resultado, los pacientes reciben un tratamiento más efectivo y menos invasivo que los métodos tradicionales.
Principales radionúclidos utilizados: Lu-177, Ac-225 y más
Los radionúclidos más utilizados en terapias teranósticas incluyen:
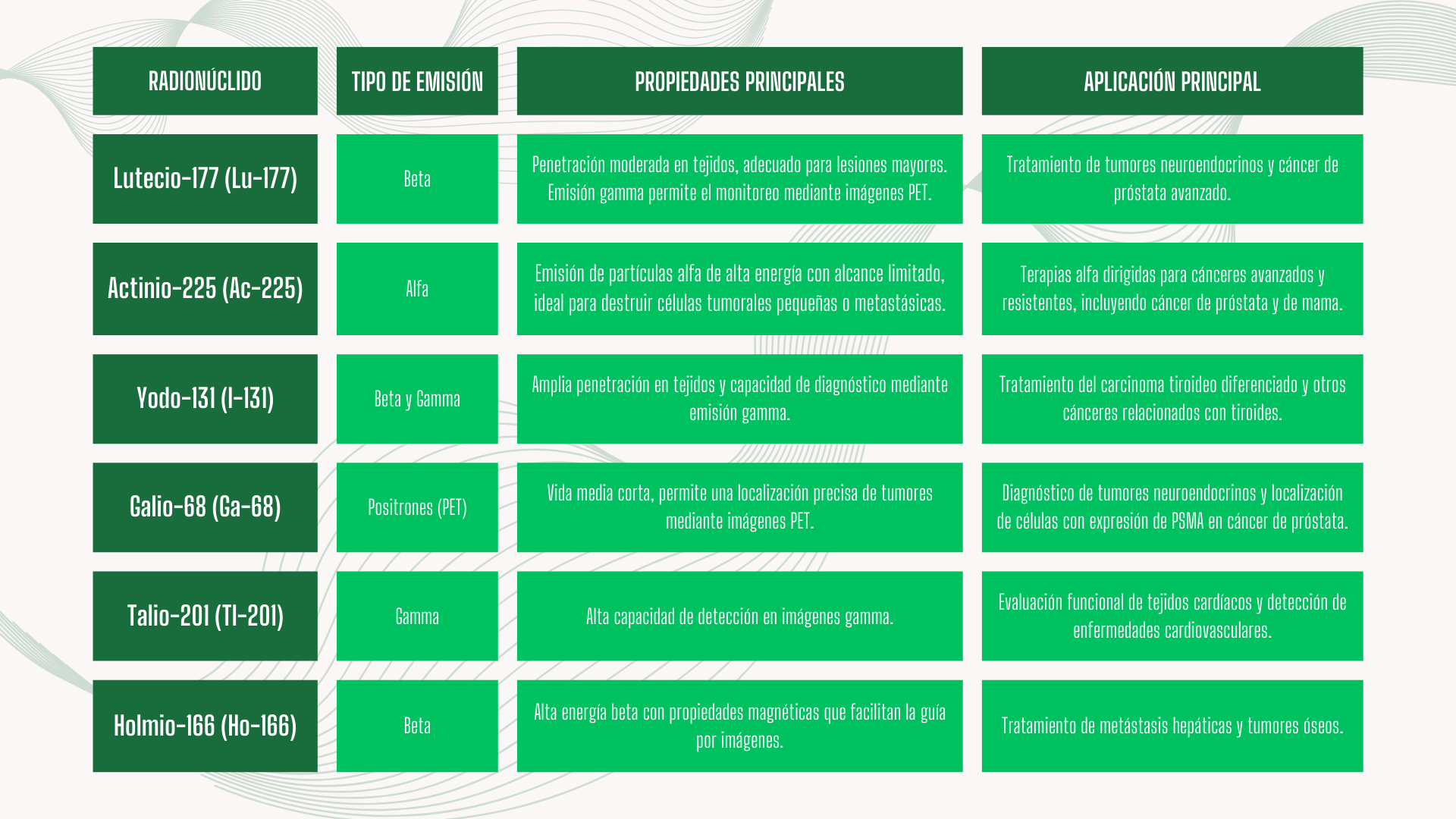
Cada uno de estos radionúclidos tiene propiedades específicas que los hacen adecuados para distintos tipos de cáncer. Por ejemplo, el actinio-225 emite partículas alfa de alta energía, ideales para tratar tumores pequeños o metastásicos, mientras que el lutecio-177 es más adecuado para lesiones mayores debido a su mayor alcance de penetración.
Estas características permiten personalizar las terapias en función del tipo de enfermedad y las necesidades del paciente, aumentando las posibilidades de éxito clínico.
Diferencias frente a las terapias tradicionales
A diferencia de la quimioterapia y la radioterapia convencional, las terapias teranósticas ofrecen una mayor especificidad y menos efectos secundarios.
- Quimioterapia: Actúa de forma sistémica, afectando tanto a células malignas como sanas. Esto puede causar toxicidad significativa, como náuseas, inmunosupresión y caída del cabello.
- Radioterapia convencional: Aunque es más localizada que la quimioterapia, puede afectar tejidos sanos cercanos al área tratada, aumentando el riesgo de complicaciones.
En contraste, las terapias teranósticas utilizan radiofármacos que se dirigen exclusivamente a las células tumorales. Por ejemplo, un estudio reciente mostró que el uso de Lu-177-PSMA en pacientes con cáncer de próstata metastásico redujo la progresión del tumor en un 50 % más que los tratamientos estándar, con efectos secundarios limitados.
Además, el enfoque combinado de diagnóstico y tratamiento en un solo procedimiento reduce los tiempos de intervención y mejora la experiencia del paciente.
Avances recientes en terapias teranósticas
En los últimos años, las terapias teranósticas han experimentado avances significativos gracias a innovaciones tecnológicas y científicas. Estas mejoras han optimizado la precisión de los tratamientos, ampliado su aplicación clínica y demostrado su eficacia en enfermedades complejas como los cánceres avanzados o resistentes. A continuación, se describen tres áreas clave de desarrollo.
Terapias alfa dirigidas: un nuevo estándar en precisión oncológica
Las terapias alfa dirigidas son un avance destacado en oncología debido a su capacidad para administrar radiación de alta energía de forma localizada, utilizando radionúclidos emisores de partículas alfa como el actinio-225 (Ac-225). Este enfoque se caracteriza por un alcance limitado de las partículas alfa, lo que minimiza el daño al tejido sano mientras destruye eficazmente las células malignas.
En el manejo clínico cotidiano, estas terapias han sido implementadas en unidades de radiofarmacia para tratar pacientes con cáncer de próstata metastásico resistente a tratamientos estándar. Por ejemplo, el compuesto Ac-225-PSMA se ha utilizado para reducir el tamaño tumoral y disminuir los niveles de antígeno prostático específico (PSA) en más del 70 % de los pacientes tratados, con efectos secundarios limitados como xerostomía. Además, se están investigando aplicaciones de estos emisores alfa en tumores neuroendocrinos y cáncer de mama triple negativo, mostrando resultados preliminares prometedores.
En las unidades de radiofarmacia, la preparación de compuestos con Ac-225 requiere estrictos controles de calidad debido a su vida media corta y alta potencia. Esto subraya la importancia de la capacitación especializada en la manipulación y dosimetría de estos radionúclidos.
Uso de gemelos digitales para optimizar tratamientos personalizados
Los gemelos digitales son simulaciones virtuales que replican las características fisiológicas y biomoleculares de un paciente. En el contexto de las terapias teranósticas, permiten predecir con precisión la distribución y efectividad de los radiofármacos antes de su administración, lo que optimiza la planificación y personalización del tratamiento.
Desde un punto de vista técnico, estas herramientas se basan en modelos farmacocinéticos basados en fisiología (PBPK), que simulan procesos clave del organismo, como:
- Absorción y distribución: Determinan cómo el radiofármaco se transporta y localiza en los tejidos.
- Metabolismo y excreción: Evalúan cómo el compuesto es procesado y eliminado, considerando órganos como el hígado y los riñones.
- Afinidad molecular: Analizan la interacción del radiofármaco con receptores específicos en las células tumorales.
En la práctica, estos modelos integran parámetros individuales del paciente, como flujo sanguíneo, función renal y hepática, y características del tumor, para ajustar las dosis de manera personalizada. Por ejemplo, en pacientes con tumores neuroendocrinos tratados con lutecio-177 (Lu-177), los gemelos digitales ayudan a calcular la exposición del radiofármaco en órganos críticos, como los riñones y la médula ósea, minimizando los riesgos de toxicidad.
Además, estas herramientas se están integrando en sistemas de gestión hospitalaria para mejorar la toma de decisiones clínicas. Por ejemplo:
- Antes de cada sesión de tratamiento, un sistema hospitalario puede utilizar un gemelo digital para simular cómo responderá el paciente a una dosis de Lu-177, ajustando la administración en tiempo real.
- Esto permite optimizar la dosimetría y garantizar la seguridad del paciente, mientras se mejora la gestión de recursos en las unidades de radiofarmacia.
Estudios recientes indican que la incorporación de gemelos digitales puede reducir en un 30 % las complicaciones relacionadas con la sobredosificación, demostrando su impacto clínico directo. Estas herramientas representan un avance significativo hacia la personalización de las terapias teranósticas, alineándose con los objetivos de la medicina de precisión.
Desarrollo de radiofármacos específicos para tumores difíciles de tratar
El diseño de nuevos radiofármacos está ampliando las posibilidades terapéuticas en tipos de cáncer altamente resistentes, como el cáncer de mama triple negativo y el cáncer de páncreas. Estos compuestos se desarrollan para dirigirse a receptores específicos de las células tumorales, mejorando la especificidad del tratamiento.
En el cáncer de mama triple negativo, los radiofármacos basados en lutecio-177, acoplados a moléculas dirigidas a receptores de superficie como el TROP-2, han mostrado una reducción tumoral significativa en ensayos preclínicos. En el cáncer de páncreas, los radiofármacos que utilizan marcadores dirigidos al receptor de quimiocinas CXCR4 están siendo evaluados en estudios clínicos iniciales, mostrando mejoras en la supervivencia a corto plazo.
La implementación de estos radiofármacos en unidades de radiofarmacia requiere la adopción de tecnologías avanzadas para su producción y administración, así como protocolos estrictos para garantizar su seguridad y eficacia.
Aplicaciones clínicas: transformando el tratamiento del cáncer
Las terapias teranósticas están revolucionando el manejo clínico de diversos tipos de cáncer, ofreciendo opciones de tratamiento más precisas y efectivas para enfermedades complejas y avanzadas. A continuación, se presentan casos específicos que ilustran el impacto de estas innovaciones en el ámbito clínico.
Terapias en tumores neuroendocrinos con Lu-177: resultados clínicos y eficacia
El lutecio-177 (Lu-177) se ha consolidado como una de las terapias más efectivas en el tratamiento de tumores neuroendocrinos avanzados. Estos tumores, caracterizados por su crecimiento lento pero comportamiento agresivo en etapas avanzadas, responden favorablemente a los radiofármacos dirigidos. La capacidad de Lu-177 para localizar y destruir células tumorales ha transformado el manejo clínico de esta enfermedad.
Resultados clínicos destacados
Estudios clínicos, como el ensayo multicéntrico NETTER-1, han demostrado el impacto positivo de la terapia con Lu-177-DOTATATE en pacientes con tumores neuroendocrinos progresivos. Los resultados de este ensayo indicaron:
- Una reducción del 79 % en el riesgo de progresión de la enfermedad en comparación con el tratamiento estándar (octreótido de alta dosis).
- Una mediana de supervivencia libre de progresión de 28.4 meses, frente a 8.4 meses en el grupo control.
- Mejoras significativas en la calidad de vida, incluyendo la reducción de síntomas como dolor abdominal y diarrea, comunes en estos pacientes.
Aplicación en entornos clínicos
La administración de Lu-177-DOTATATE se realiza en unidades de radiofarmacia especializadas, donde se siguen protocolos estrictos para garantizar la seguridad y eficacia del tratamiento. Este proceso incluye:
- Preparación del radiofármaco: El Lu-177-DOTATATE se sintetiza en laboratorios con certificación GMP (Good Manufacturing Practice) y se somete a pruebas de calidad para verificar su pureza y actividad específica antes de ser administrado.
- Dosimetría personalizada: Se calcula la dosis adecuada para cada paciente en función de parámetros como peso, función renal y características del tumor. Este cálculo busca maximizar la eficacia terapéutica mientras se minimiza la exposición a órganos críticos como los riñones y la médula ósea.
- Administración intravenosa: El tratamiento se administra mediante infusión controlada, generalmente en cuatro ciclos separados por intervalos de seis a ocho semanas, bajo monitoreo continuo de parámetros vitales y niveles de radiación.
Impacto en decisiones terapéuticas
La evidencia clínica obtenida del ensayo NETTER-1 ha llevado a la adopción de Lu-177-DOTATATE como tratamiento de referencia para pacientes con tumores neuroendocrinos avanzados. Su capacidad para prolongar la supervivencia y mejorar la calidad de vida lo ha convertido en una opción preferida en guías internacionales. Además, los datos de dosimetría recopilados durante los tratamientos están ayudando a optimizar futuras terapias y a personalizar aún más las intervenciones en función de las características específicas de cada paciente.
Cáncer de próstata metastásico y terapias dirigidas al PSMA
El cáncer de próstata metastásico resistente a la castración es una condición difícil de tratar, caracterizada por la progresión de la enfermedad a pesar de la supresión hormonal. En este contexto, las terapias dirigidas al antígeno prostático específico de membrana (PSMA), como el Lu-177-PSMA, han revolucionado el manejo de esta enfermedad, ofreciendo una solución efectiva para pacientes con pocas opciones terapéuticas.
Resultados clínicos destacados
El Lu-177-PSMA actúa selectivamente sobre células tumorales que expresan PSMA, lo que permite destruir estas células sin afectar significativamente los tejidos circundantes. Este enfoque ha demostrado resultados clínicos prometedores:
- En el ensayo clínico VISION, los pacientes tratados con Lu-177-PSMA mostraron una mejora del 38 % en la supervivencia global en comparación con las terapias estándar.
- La supervivencia libre de progresión se incrementó en un 60 %, reflejando una ralentización significativa en la progresión del cáncer.
- Además, se observaron beneficios en términos de reducción del dolor óseo asociado con metástasis y una mejora general en la calidad de vida.
Implementación en la práctica clínica
La administración de Lu-177-PSMA sigue un protocolo especializado que se lleva a cabo en unidades de radiofarmacia y medicina nuclear. Este protocolo incluye:
- Preparación y calidad del radiofármaco: El Lu-177-PSMA se sintetiza bajo condiciones GMP, asegurando la pureza y la actividad específica del compuesto. Antes de la administración, se verifica su calidad mediante pruebas de biodistribución y estabilidad.
- Dosimetría personalizada: Se calcula la dosis óptima para cada paciente en función de su masa corporal, la extensión de la enfermedad y la función renal. Este enfoque permite equilibrar la eficacia del tratamiento con la minimización de efectos secundarios.
- Administración controlada: El radiofármaco se administra mediante infusión intravenosa en ciclos de tratamiento espaciados entre seis y ocho semanas. Durante cada sesión, el equipo médico monitorea de cerca la respuesta del paciente y los niveles de radiación.
Impacto en decisiones terapéuticas
El uso de Lu-177-PSMA ha transformado las decisiones terapéuticas en cáncer de próstata metastásico avanzado. Su efectividad y baja incidencia de efectos secundarios graves, como xerostomía y náuseas leves, lo han posicionado como una opción preferida en pacientes que han agotado las terapias convencionales. Además, los datos generados en ensayos clínicos están siendo utilizados para refinar los criterios de selección de pacientes, asegurando que aquellos que más se beneficien sean los principales candidatos.
Logística y coordinación
Implementar esta terapia en centros clínicos requiere una coordinación precisa entre oncólogos, médicos nucleares y radiofarmacéuticos. Las unidades deben garantizar:
- La disponibilidad puntual del Lu-177, teniendo en cuenta su vida media (6,7 días), lo que limita los tiempos de transporte y almacenamiento.
- La programación eficiente de sesiones de tratamiento para maximizar la actividad del radiofármaco y evitar desperdicios.
Terapias alfa dirigidas en el tratamiento del cáncer de mama triple negativo
El cáncer de mama triple negativo (CMTN) es una de las variantes más agresivas de esta enfermedad, debido a la ausencia de receptores hormonales y HER2, lo que limita las opciones terapéuticas convencionales. En este contexto, las terapias alfa dirigidas han emergido como una opción prometedora, ofreciendo un enfoque innovador para pacientes con tumores avanzados o metastásicos resistentes a la quimioterapia.
Resultados clínicos y avances recientes
Los emisores alfa, como el actinio-225 (Ac-225), han demostrado una notable eficacia en ensayos clínicos. Estos radionúclidos, acoplados a ligandos dirigidos a receptores específicos en células tumorales, permiten una destrucción precisa de las células malignas sin afectar significativamente los tejidos circundantes.
- Un estudio reciente evaluó el uso de Ac-225 acoplado a ligandos que se dirigen al receptor de folato, ampliamente expresado en el CMTN. Los resultados mostraron una reducción tumoral significativa en más del 50 % de los pacientes evaluados, incluso en aquellos con metástasis diseminadas.
- Este avance es particularmente alentador para pacientes que han agotado otras opciones terapéuticas, como quimioterapia o inmunoterapia, ofreciendo nuevas esperanzas en el manejo de esta enfermedad.
Aplicación práctica en entornos clínicos
La administración de terapias alfa dirigidas se lleva a cabo en entornos controlados que garantizan la seguridad y eficacia del tratamiento:
- Preparación del radiofármaco: El Ac-225 se sintetiza y acopla a ligandos específicos en laboratorios con certificación GMP, asegurando la estabilidad química del compuesto.
- Dosimetría y personalización del tratamiento: Dada la alta potencia de las partículas alfa y su alcance limitado, se realizan cálculos dosimétricos precisos para garantizar que la radiación se dirija exclusivamente al tumor. Esto minimiza el riesgo de toxicidad en órganos como los riñones o el hígado.
- Administración intravenosa en ciclos: Similar a otras terapias teranósticas, el tratamiento se administra en ciclos espaciados, permitiendo monitorear la respuesta del paciente y ajustar la dosis según sea necesario.
Impacto clínico y beneficios
El principal beneficio de las terapias alfa dirigidas radica en su alta especificidad, lo que permite tratar tumores avanzados sin los efectos secundarios significativos asociados con la quimioterapia convencional. Entre los beneficios observados se incluyen:
- Reducción significativa del tamaño tumoral, especialmente en pacientes con metástasis óseas o viscerales.
- Mejora de la tolerancia al tratamiento: Los efectos secundarios como náuseas o fatiga son significativamente menores en comparación con las terapias estándar.
- Posibilidades de combinación con otras terapias: Investigaciones actuales están explorando el uso combinado de emisores alfa con inmunoterapia, lo que podría potenciar aún más los resultados.
Perspectivas futuras
El desarrollo de terapias alfa dirigidas continúa avanzando, con investigaciones en curso sobre nuevos ligandos y emisores que podrían expandir su aplicación a otros tipos de cáncer. En el caso del CMTN, estos tratamientos representan un cambio de paradigma, ofreciendo una opción eficaz para pacientes en los que las terapias convencionales han fallado.
Retos y oportunidades en la implementación de terapias teranósticas
La implementación de terapias teranósticas presenta desafíos significativos en términos de logística, regulación y formación de profesionales, pero también ofrece oportunidades para expandir su alcance y mejorar los resultados clínicos. Este apartado analiza los principales retos y estrategias para superarlos, destacando la importancia de la colaboración interdisciplinaria y la formación especializada.
Desafíos en la producción y distribución de radiofármacos
La producción y distribución de radiofármacos para terapias teranósticas enfrenta problemas logísticos derivados de la naturaleza de los radionúclidos. Muchos de estos compuestos tienen una vida media corta, como el lutecio-177 (6,7 días) o el actinio-225 (10 días), lo que limita su transporte y almacenamiento. Esto plantea la necesidad de contar con instalaciones de producción cercanas a los centros de tratamiento.
Además, la infraestructura necesaria para garantizar la calidad y seguridad de los radiofármacos, como laboratorios con estándares GMP (Good Manufacturing Practice), es costosa y no está disponible en todas las regiones. Esto afecta especialmente a hospitales y clínicas de áreas remotas o países en desarrollo.
Una estrategia clave para abordar estos desafíos es la creación de redes de producción descentralizadas, utilizando ciclotrones y reactores locales para minimizar los tiempos de transporte. Asimismo, la inversión en tecnologías avanzadas de empaquetado y transporte seguro podría ampliar la disponibilidad de estos tratamientos a nivel global.
Consideraciones regulatorias y normativas internacionales
Las regulaciones en torno a las terapias teranósticas varían significativamente entre regiones, lo que puede ralentizar el desarrollo y la implementación de estas innovaciones. En muchos casos, los procesos de aprobación para nuevos radiofármacos son complejos y prolongados, lo que dificulta su llegada al mercado.
Por ejemplo, en la Unión Europea, los radiofármacos deben cumplir tanto con normativas específicas de la Agencia Europea de Medicamentos (EMA) como con regulaciones nacionales, lo que a menudo genera retrasos en su adopción. En contraste, países como Estados Unidos cuentan con un marco regulatorio más homogéneo a través de la FDA, facilitando un acceso más rápido.
La falta de armonización normativa también afecta la colaboración internacional en investigación y producción. Una solución sería promover acuerdos globales que estandaricen los requisitos regulatorios, fomentando el intercambio de datos y la aprobación conjunta de radiofármacos. Organismos como la IAEA (Agencia Internacional de Energía Atómica) desempeñan un papel clave en este esfuerzo.
Formación de profesionales especializados en radioquímica y farmacia nuclear
La implementación efectiva de terapias teranósticas requiere un personal altamente capacitado en radioquímica, farmacia nuclear y dosimetría clínica. Sin embargo, la falta de programas educativos especializados representa un desafío importante.
Formar a nuevos profesionales implica no solo transmitir conocimientos técnicos, sino también desarrollar competencias prácticas en la manipulación de radiofármacos y el cumplimiento de normativas internacionales. Programas como el Diploma de Experto en Fundamentos de Radioquímica y Farmacia Nuclear de la Universidad Internacional de Andalucía abordan estas necesidades, ofreciendo formación integral para quienes buscan especializarse en este campo.
Además, fomentar la colaboración entre instituciones académicas, hospitales y la industria farmacéutica puede acelerar la formación de especialistas. Esto incluye la creación de programas de prácticas y la incorporación de módulos sobre innovaciones como terapias alfa dirigidas y gemelos digitales.
Perspectivas futuras y la importancia de la innovación
Las terapias teranósticas están en constante evolución, impulsadas por avances en la tecnología y un entendimiento más profundo de la biología molecular del cáncer. Este apartado explora las direcciones futuras de estas terapias, incluyendo el desarrollo de combinaciones innovadoras, el rol de la inteligencia artificial y su potencial expansión global.
Potencial de nuevas combinaciones de radionúclidos y moléculas terapéuticas
El futuro de las terapias teranósticas está marcado por la búsqueda de combinaciones más efectivas entre radionúclidos y moléculas terapéuticas dirigidas. Estas combinaciones tienen como objetivo aumentar la especificidad del tratamiento, minimizar la toxicidad en tejidos sanos y mejorar la eficacia en tumores resistentes.
Ejemplos concretos de investigaciones actuales
Estudios recientes han evaluado la combinación de lutecio-177 (Lu-177) con moléculas dirigidas al antígeno prostático específico de membrana (PSMA), utilizadas tanto para el diagnóstico como para el tratamiento de cáncer de próstata avanzado. En el ensayo clínico VISION, esta combinación demostró mejorar la supervivencia global y reducir la progresión tumoral en pacientes con metástasis avanzadas.
Otra línea de investigación preclínica se centra en el uso de terbio-161 (Tb-161), un radionúclido que combina emisión beta y gamma. Este compuesto permite simultáneamente la administración de terapia dirigida y la obtención de imágenes de alta resolución para monitorear el tratamiento en tiempo real. Los estudios iniciales indican que el terbio-161 podría ser especialmente útil en tumores de pequeño tamaño, donde se requiere una precisión terapéutica y diagnóstica superior.
Uso combinado de emisores alfa y beta
El desarrollo de radiofármacos que integren emisores alfa y beta en un único compuesto es otra dirección prometedora. Esta combinación permite tratar tumores con diferentes características:
- Emisores alfa, como el actinio-225, tienen un alcance limitado pero un alto poder destructivo en células tumorales específicas.
- Emisores beta, como el lutecio-177, ofrecen mayor penetración en tejidos, siendo más efectivos en lesiones de mayor tamaño o distribución.
En modelos preclínicos, la combinación de lutecio-177 y actinio-225 ha demostrado una reducción significativa del tamaño tumoral en pacientes con metástasis heterogéneas. Esta estrategia no solo maximiza la eficacia, sino que también permite personalizar el tratamiento según las características específicas del tumor y la distribución de las metástasis.
Innovaciones en moléculas bivalentes
Además, se están desarrollando moléculas bivalentes capaces de transportar simultáneamente dos radionúclidos diferentes, mejorando la eficacia terapéutica y el control diagnóstico. Estas moléculas podrían combinar emisores gamma para obtener imágenes precisas con emisores alfa o beta para la destrucción de células tumorales, ampliando las posibilidades de la medicina personalizada.
La capacidad de diseñar radiofármacos personalizados mediante herramientas avanzadas de química médica y biología molecular abre nuevas posibilidades en el manejo de tumores agresivos y resistentes. Estas combinaciones representan una evolución hacia tratamientos más efectivos y adaptados a las necesidades específicas de cada paciente.
Rol de la inteligencia artificial en el diseño y evaluación de tratamientos
La inteligencia artificial (IA) está emergiendo como una herramienta revolucionaria en el diseño y evaluación de terapias teranósticas. Los algoritmos de aprendizaje automático pueden analizar grandes cantidades de datos clínicos y preclínicos, identificando patrones que optimizan la selección de radiofármacos y ajustan las dosis para maximizar su eficacia.
Por ejemplo, herramientas basadas en IA ya están siendo utilizadas para predecir la distribución de radiofármacos en diferentes tipos de tejidos, mejorando la planificación dosimétrica. Investigaciones actuales están aplicando modelos predictivos para seleccionar radionúclidos específicos y moléculas dirigidas según las características genéticas y fenotípicas de los tumores.
En el futuro, se espera que la IA permita un diseño más rápido de nuevos radiofármacos y la simulación virtual de tratamientos personalizados mediante gemelos digitales. Estas simulaciones podrán prever la respuesta del paciente al tratamiento, reduciendo la necesidad de ensayos clínicos extensos y costosos.
La expansión global de las terapias teranósticas: impacto en países de ingresos medios y bajos
A pesar de su potencial, las terapias teranósticas enfrentan barreras significativas en su adopción global, especialmente en países de ingresos medios y bajos. La infraestructura limitada para la producción de radiofármacos y el costo de las tecnologías avanzadas son obstáculos importantes.
Sin embargo, iniciativas internacionales lideradas por organismos como la Agencia Internacional de Energía Atómica (IAEA) están trabajando para mejorar el acceso. Programas de capacitación en radiofarmacia y la instalación de ciclotrones regionales están ayudando a reducir la dependencia de las importaciones de radionúclidos.
Además, la colaboración entre instituciones académicas y gobiernos está promoviendo el desarrollo de terapias más asequibles y sostenibles. Por ejemplo, se están explorando radionúclidos de menor costo y técnicas de producción local para reducir los precios de los tratamientos sin comprometer su calidad.
La integración de estas terapias en sistemas de salud más amplios podría transformar el panorama del cáncer en regiones con recursos limitados, aumentando la equidad en el acceso a la medicina nuclear avanzada.
Conclusión
Las terapias teranósticas están redefiniendo el tratamiento del cáncer y otras enfermedades complejas, combinando innovación tecnológica con un enfoque personalizado que mejora significativamente los resultados clínicos. A medida que se desarrollan nuevas combinaciones de radionúclidos, se integra la inteligencia artificial y se expanden estas terapias a nivel global, las oportunidades de transformación en la medicina nuclear son vastas.
Sin embargo, para aprovechar plenamente este potencial, es esencial continuar invirtiendo en investigación, mejorar la formación de profesionales especializados y garantizar el acceso equitativo a estas terapias. La colaboración interdisciplinaria y el compromiso con la innovación serán fundamentales para consolidar las terapias teranósticas como un pilar de la medicina personalizada en las próximas décadas.
¿Quieres ser parte de la nueva generación de especialistas en radioquímica y farmacia nuclear? Infórmate sobre el Diploma de Experto en Fundamentos de Radioquímica y Farmacia Nuclear de la Universidad Internacional de Andalucía. Da el primer paso hacia una carrera en uno de los campos más innovadores y de alta demanda en la medicina moderna.